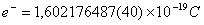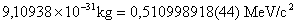Odkrycie
elektronu
Odkrycie elektronu
zapoczątkował Michael Faraday, który w 1838 roku przepuścił prąd
elektryczny
przez szklaną rurę, zawierającą rozrzedzone powietrze. W czasie tego
doświadczenia zauważono dziwny łuk świetlny, który rozciągał się od
anody
(elektrody dodatniej) prawie do katody (elektrody ujemnej). Jedynym
miejscem, w
którym nie zaobserwowano świecenia, był obszar tuż przed katodą (tak
zwana
ciemnia Faradaya). Zjawisko owego świecenia nazwano zjawiskiem promieni
katodowych, które emitowane są z
katody
w
kierunku
anody.
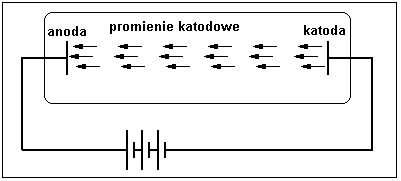
Rys.1. Zjawisko promieni katodowych.
Przez długi czas
uważano, że albo świecenie w rurze powodują jakieś cząsteczki, albo
promienie
katodowe mają naturę falową.
W 1896 roku
wątpliwości te rozwiał Joseph John Thomson w oparciu o swój
eksperyment, w
którym wykorzystał rurę z rozrzedzonym gazem służącą do wytwarzania
promieni
katodowych. Zrobił on w anodzie niewielki otwór, dzięki któremu część
promieni
katodowych, uformowanych w wąską wiązkę, wychodziła poza obszar
elektrod.
Przechodziła ona przez długą rurę próżniową i padała na fluorescencyjny
ekran,
który umieszczony był na jej końcu. Na ekranie, w miejscu padania
wiązki,
powstawała świecąca plamka. Ponadto w rurze próżniowej umieszczone
zostały dwie
metalowe płyty, podłączone do baterii, między którymi wytwarzane było
napięcie
elektryczne. Wiązka promieni katodowych przebiegała pomiędzy płytami
tak, że
kierunek pola był do niej prostopadły. Po wytworzeniu pola
elektrycznego
okazało się, że wiązka ulega ugięciu (jej obraz na ekranie zmieniał
swoje
położenie), co było dowodem na to, że promienie katodowe składają się z
cząstek, które obdarzone są ładunkiem elektrycznym. Kierunek ugięcia
wiązki wskazywał
na to, że cząstki obdarzone są ładunkiem ujemnym.
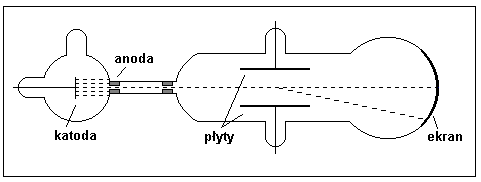
Rys.2. Aparatura Thomsona do
wytwarzania
promieni
katodowych.
Cząstki,
wchodzące
w
skład
wiązki,
nazwano elektronami. Thomson stwierdził także, iż elektrony są
składnikami
wszystkich atomów, a promienie katodowe to elektrony, które oddzieliły
się od
atomów.
Lampa elektronowa
Thomsona została również zastosowana do ilościowego zbadania ugięcia
wiązki
elektronów w polu magnetycznym i elektrycznym. Zjawiska te mogły być
obserwowane dzięki wbudowanym płytkom odchylania pionowego (pole
elektryczne)
oraz generacji zewnętrznego pola magnetycznego, które wytwarzane było
przez
parę cewek. Jeżeli pola magnetyczne i elektryczne są względem siebie
prostopadłe, to na strumień elektronów w ruchu działają przeciwnie
skierowane siły pola elektrycznego i magnetycznego. Dobranie
odpowiednich
wartości tych pól prowadzi do zrównoważenia sił i w ten sposób można
wyznaczyć
ładunek właściwy elektronu e/m.
Wyznaczanie
ładunku właściwego elektronu e/m
W czasach Thomsona
wiadome było, że atomy nie są naładowane elektrycznie, zatem muszą
zawierać dodatni
ładunek elektryczny, który równoważy ujemny ładunek elektronów. Thomson
zaproponował, że dodatni ładunek atomu jest rozłożony równomiernie w
całej
objętości atomu, a elektrony drgają wokół ściśle określonych położeń
(model
takiego atomu nazwany został modelem „ciasta z rodzynkami”).
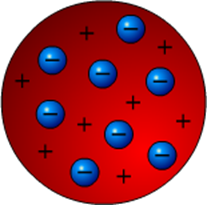
Rys.3. Model
atomu Thomsona.
Na
początku
XX
wieku
Rutherford
zasugerował,
że
elektrony
krążą
wokół jądra po
orbitach, w
taki sam sposób, jak planety wokół Słońca. Koncepcja ta budziła wiele
kontrowersji, gdyż prawa fizyki, jakie wówczas znano, nie dopuszczały
możliwości istnienia takiego atomu.
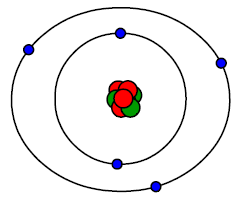
Rys.4.
Model
atomu
Rutherforda.
Krążące
ładunki
elektryczne
powinny
wypromieniowywać
energię
i
w
ułamku
sekundy spadać wzdłuż spiralnego
toru na
jądro. Rozwiązanie tego problemu polegało na skwantowaniu energii
elektronów w
atomach, które zaproponowane zostało przez Nielsa Bohra. Postulował on,
że
elektrony w atomach mogą mieć tylko pewne ściśle określone wartości
energii.
Elektrony zamiast wypromieniowywać energię w sposób ciągły i posuwać
się
spiralnie w głąb atomu, mogą przeskakiwać z jednego stanu
energetycznego na
inny, emitując lub pochłaniając tyle energii, żeby jej całkowita ilość
miała
zawsze stałą wartość. Dopóki elektron znajduje się na orbicie, energia
nie jest
wypromieniowywana, ale jeżeli przechodzi on ze stanu o wyższej energii,
do
stanu o niższej energii, to emituje energię. Skwantowano nie tylko
energię, ale
także moment pędu elektronu, krążącego po orbicie. Kwantowanie to
polegało na
ograniczeniu dopuszczalnych wartości momentu pędu do całkowitych
wielokrotności
stałej Plancka 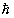 .
Stwierdzono,
że
elektron
ma
własny,
wewnętrzny
moment
pędu
(spin) o wartości 1/2
.
Stwierdzono,
że
elektron
ma
własny,
wewnętrzny
moment
pędu
(spin) o wartości 1/2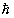 .
.
| Symbol |
e
|
| Klasyfikacja |
lepton,
fermion
|
| Ładunek |
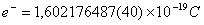 |
| Masa |
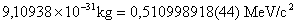 |
| Spin |
1/2
|
Tabela: Podstawowe
własności elektronu.





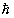 .
Stwierdzono,
że
elektron
ma
własny,
wewnętrzny
moment
pędu
(spin) o wartości 1/2
.
Stwierdzono,
że
elektron
ma
własny,
wewnętrzny
moment
pędu
(spin) o wartości 1/2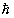 .
.